¿Cuáles son las cuatro leyes del Universo?
Hoy les hablaré del libro que lleva por título el del artículo de hoy cuyo contenido se refiere a las cuatro leyes de la termodinámica. Tiene un nivel bastante alto, lo que me lleva a deciles que no lo puedo recomendar si no eres algo especialistas en la materia. Me refiero a tener claros conceptos como entalpía, entropía y tener nociones del ciclo de Carnot. No obstante, si conocéis dichos conceptos, el libro se torna muy interesante y recomendable. Me he animado a comentarlo porque dedica un capítulo a temperaturas negativas y he creído que encontraras el tema interesante.
Para empezar, el autor da un repaso a las leyes de la termodinámica partiendo del desconocimiento de las medidas macroscópicas (como presión y temperatura), y las va introduciendo en la ley correspondiente. Es bonito ver cómo van surgiendo los conceptos de las leyes de forma “natural”.
Curiosamente, existe la Ley Cero de la Termodinámica. Se llamó así porque la Primera y la Segunda ya estaban estipuladas y era difícil cambiar la numeración. Básicamente dice que si A está en equilibrio con B y B está en equilibrio con C entonces A está en equilibrio con C. Sí, podéis pensar que es una obviedad, pero el termómetro es un aparato que se basa en esta ley. Tenemos un sistema A a cierta temperatura. Ponemos el termómetro B en contacto y vemos que no cambia. Ahora, lo ponemos con C y vemos que tampoco cambia. Concluimos que A y C están a la misma temperatura. Y también, curiosamente, los termodinámicos prestan más atención a los procesos cuando no cambia nada que cuando cambia algo.
Las escalas de medición de temperaturas más conocidas son las Celsius (o centígrada) y Farenheit. La primera debe su nombre al astrónomo sueco Anders Celsius que concibió una escala en la que el agua se congelaba a 0ºC y hervía a 100ºC. El fabricante de instrumentos Daniel Farenheit fue el primero que utilizó mercurio para la fabricación de un termómetro. La temperatura más baja que pudo alcanzar en el laboratorio fue con una mezcla de hielo, agua y sal. A ese punto le puso su 0ºF y para los 100ºF escogió la temperatura corporal. En esa escala, el agua hierve a 212ºF. La gran ventaja que tuvo para aquella época es que no se precisaba de valores negativos para medir temperaturas.
La termodinámica tiene dos enfoques que conviene distinguir: la clásica y la estadística. La termodinámica clásica es la que surgió el siglo XIX antes de que la realidad de los átomos fuera plenamente aceptada y se ocupa de las relaciones entre propiedades macroscópicas.
Hacia finales del siglo XIX, los científicos empezaron a aceptar la existencia de los átomos y surgió la termodinámica estadística que buscaba recuperar las propiedades macroscópicas (insisto: presión, temperatura, etc.) en términos de las propiedades de los átomos que constituían los sistemas como velocidad de la partícula, choque con las paredes, energía de las mismas, etc.
¿Por qué “estadística”?
Mientras la dinámica se ocupa del comportamiento de cada cuerpo por separado, la termodinámica lo hace del comportamiento medio de gran número de ellos. Cuando hablamos de “gran número”, estamos hablando del orden del Número de Avogadro (6′02*1023) partículas y con números tan grandes podemos hacer estadística.
La termodinámica, como gran parte del resto de la ciencia, utiliza términos de uso cotidiano afinándolos de manera que adquieren un significado exacto y no ambiguo. Por ejemplo, todos sabemos que algo que está a 50ºC tiene más temperatura que algo que está a 40ºC, pero ¿qué significa exactamente a nivel molecular que algo esté a 50ºC? ¿Es la temperatura una medida absoluta de algo o es una medida relativa? Y como quiero hablaros de temperaturas negativas, he de definiros qué es temperatura y para ello he de partir de un detalle de la mecánica cuántica.
La mecánica cuántica nos enseña que un átomo puede tener ciertas energías. A temperatura 0 en la escala absoluta (escala Kelvin), todos los átomos estarían en su nivel más bajo, o, mejor, su nivel fundamental de energía. A medida que comunicamos energía al sistema, algunos átomos empiezan a ir a niveles superiores. Comunicamos más energía y más átomos van a niveles superiores. No lo hacen de una forma caótica, sino siguiendo una distribución exponencial. Los cálculos son cortesía del genial teórico Ludwig Boltzmann, y la distribución que siguen los átomos, tal como os la he definido, se conoce como Distribución de Boltzmann.
Un gas es un conjunto caótico de moléculas (de hecho, las palabras “gas” y “caos” provienen de la misma raíz), y es caótico tanto en la distribución espacial de las mismas como la distribución de sus velocidades. Cada velocidad se corresponde con una energía cinética dada y se puede utilizar la distribución de Boltzmann para expresar la distribución de estas velocidades y relacionar dicha distribución con la temperatura.
La expresión resultante se llama Estadística de Maxwell-Boltzmann, ya que fue James Clerk Maxwell el primero que la dedujo de una forma ligeramente diferente. Cuando se hace este cálculo encontramos que la velocidad media de las moléculas crece con el cuadrado de la temperatura absoluta. Podemos pensar, entonces, en la temperatura como en una medida de la velocidad media de las moléculas de un gas. Temperaturas altas corresponden a velocidades medias altas y temperaturas bajas a velocidades medias bajas.
A medida que se aumenta la temperatura de un gas, las poblaciones de moléculas se desplazan a estados de mayor energía, o sea, que cada vez serán más las moléculas que se mueven más vigorosamente. En el caso de un sólido lo que sucede es que las moléculas, atrapadas en su posición, vibran con mayor vigor en torno a sus posiciones de equilibrio. Agitación y temperatura son conceptos similares.
No confundir temperatura con calor. El calor, en lenguaje cotidiano, fluye de un cuerpo a otro. En termodinámica, el calor no es un ente, ni siquiera una forma de energía: el calor es un modo de transferencia de energía en virtud de una diferencia de temperaturas.
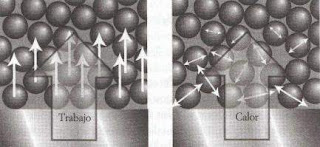
Existe un equivalente entre trabajo y calor. Aun así, son cosas diferentes. Para empezar, existen calentadores y no trabajadores. Cuando levantamos un bloque hacemos trabajo sobre él. Todos los átomos se moverán en la misma dirección y sentido de manera uniforme. Lo mismo sucede al comprimir o estirar u muelle. Por tanto, el trabajo es la transferencia de energía mediante el movimiento uniforme de los átomos en el medio.
Ahora bien, si ponemos en contacto un bloque de hierro caliente con otro frío, los átomos del bloque caliente oscilan con mayor vigor y empujarán a los átomos del bloque más frío que vibran con menor intensidad. Los átomos del bloque más frío empezarán a moverse con mayor vigor, justo al contrario que los del bloque más caliente. No obstante, ninguno de los bloques se moverá al ponerlos en contacto, pues los movimientos de las moléculas que los componen son aleatorios. Por tanto, el calor es la transferencia de energía mediante el movimiento aleatorio de los átomos en el medio.
Esta diferenciación molecular entre calor y trabajo aclara un aspecto del nacimiento de la civilización. El fuego, el suministro caótico de energía, es fácil de conseguir ya que el desorden no está sujeto a restricción alguna. El trabajo es una energía más domesticada y requiere mayor refinamiento. Por ello, la humanidad se topó rápidamente con el fuego, pero necesitó milenios para llegar a la máquina de vapor, el motor de combustión interna y el reactor.
Los átomos pueden moverse de diferentes maneras: desplazándose, rotando o vibrando. Los niveles de energía de traslación están tan próximos que prácticamente es un continuo. Los niveles de rotación en los gases están bastante separados. Los niveles de energía vibracional (asociados a la oscilación de los átomos en las moléculas) están muy separados.
Esta es la razón de por qué cuando se calienta un gas las moléculas se excitan fácilmente (es decir, se mueven más deprisa) y, en todos los casos prácticos, se propagan por muchos estados rotacionales. La energía interna del sistema se aumenta y sube la temperatura. En un sólido, las moléculas no pueden desplazarse ni rotar: sólo pueden vibrar. En los líquidos y en los gases el movimiento molecular está menos restringido que en los sólidos y por ello tienen más capacidad de absorber calor.
El agua tiene una capacidad calorífica muy alta, lo que significa que para calentarla se requiere mucha energía. Pero esto conlleva otra ventaja y es que tal y como es capaz de absorber la energía, también es capaz de almacenarla. Es por ello que es un buen medio para los sistemas de calefacción central y es por ello que los océanos se calientan y enfrían despacio, con la importancia que tiene para el clima de nuestro planeta.
Hoy, las menores temperaturas alcanzadas son 10-10K para los sólidos y 5*10-10K para los gases. Con estas temperaturas las moléculas se desplazan tan despacio que en 30 segundos recorren una distancia de 2,54 cm.
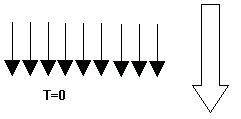
Supongamos que tenemos un sistema con una serie de spines (podemos imaginarlo como si fueran agujas imantadas). Sería un sistema en el que las moléculas sólo tienen dos estados: el estado up (el estado de mayor energía que representaremos una flecha hacia arriba “↑”) y el down (el estado de menor energía que representaremos con una flecha hacia abajo “↓”). Los spines, al someterlos a un campo magnético externo, tienden a alinearse con él. Vamos a suponer (y sólo suponer) que estamos a temperatura 0 y ponemos un campo magnético orientado hacia abajo:
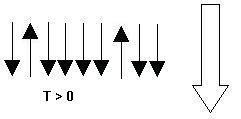
Ahora supongamos que comunicamos energía al sistema. Entonces, algunos de los spines tendrán la suficiente como para poder vencer al campo magnético y alinearse en contra del mismo:
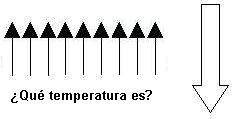
Y ahora suponed que comunicamos mucha temperatura (idealmente, infinita). ¿Cuál será el estado final? ¿pensáis que será este?:
Pues no. La segunda ley de la termodinámica nos dice que habrá aproximadamente la misma cantidad de spines up y de spines down. ¿Por qué deberían alinearse todos en un solo sentido? Si tienen energía de sobras, podrán estar, por así decirlo, en la posición que les plazca y como ya os dije, la tendencia es a ir hacia el estado que encontraremos con mayor probabilidad. Y es que, si todos se mueven como les place, lo lógico será encontrar la mitad up y la mitad down. Técnicamente hablando: cuando la temperatura es infinita, todos los estados están igualmente poblados.
Bien, dicho esto, queda una pregunta en el aire: ¿cuál es la temperatura de un estado como este?
Pensad que ya hemos cubierto el rango entre 0 e infinito y este estado no estaba en dicho rango. Recordad que habíamos dicho que según aumenta la temperatura se poblaban los niveles de mayor energía desde los de menor; pero en este caso, tenemos los niveles altos poblados y los niveles bajos vacíos. Pues bien, la respuesta es que, tal y como hemos definido temperatura, esta disposición de spines tiene temperatura negativa.
En la práctica, el concepto temperatura se aplica a sistemas como estos que tienen dos niveles posibles de energía. Se logra alineando todos los spines con el campo magnético y cuando están bien ordenaditos, se lo cambiamos de golpe. Los spines son perezosos y les cuesta moverse. Lo que hacemos así sería pillarlos “fuera de juego”. Estos mismos principios son aplicables a otros gases cuyas moléculas tienen tres o más niveles de energía. Lo que sucede es que son estados forzados y no se mantienen así mucho tiempo. Os invito a que meditéis todas estas ideas con calma.
Y no penséis que no tenéis temperaturas negativas cerca. Sabed que si tenéis un reproductor de CD o DVD que tenga un láser, trabaja con temperaturas negativas absolutas. El principio del láser es tener muchos átomos o moléculas en un estado excitado de energía y esa es la definición que hemos dado de temperatura negativa. Sobre el láser, si queréis, podemos hablar en alguna otra historia.
Este libro, aunque corto en páginas (unas 140), es muy recomendable y entretenido para el especialista.
Título: “Las cuatro leyes del Universo”
Autor: Peter Atkins